Darstellung von Molekülen
Moleküle werden auf unterschiedliche Weise dargestellt. Neben Summenformeln veranschaulichen Strukturformeln und Modelle wie das Kugel-Stab-Modell die verknüpften Atome und die räumliche Anordnung der Verbindungen.
Info für Lehrende
Mehr zu SchuBu+
Grundlagen
Moleküle werden mit Summenformeln dargestellt. Diese geben die Anzahl der verknüpften Atome an. Beispielsweise verbinden sich bei Cl2 zwei Chlor-Atome und bei H2O zwei Wasserstoff-Atome (H) mit einem Sauerstoff-Atom (O).
Verbinden sich Atome über ein Elektronenpaar (wie bei H2), so liegt eine Einfachbindung vor.
Manche Atome teilen sich mehr als ein Elektronenpaar, dadurch bilden sich Doppelbindungen (Zweifachbindungen;
Bindungswertigkeit
Die Bindungswertigkeit gibt an, wie viele Bindungen ein Atom innerhalb eines Moleküls eingeht.
Da Wasserstoff ein Elektron besitzt und ihm nur ein Elektron zur vollen Besetzung der Schale fehlt, ist dieser einwertig (Wasserstoff geht nur eine Einfachbindung ein).
| Nichtmetalle ab der 2. Periode | ||||
|---|---|---|---|---|
| Gruppe im PSE | 14 | 15 | 16 | 17 |
| Außenelektronen | 4 | 5 | 6 | 7 |
| Bindungswertigkeit | 4 | 3 | 2 | 1 |
| Bezeichnung | vierwertig | dreiwertig | zweiwertig | einwertig |
Lewis-Schreibweise
Mit der Lewis-Schreibweise werden die Außenelektronen dargestellt. Dabei wird das eine Außenelektron von Wasserstoff als Punkt geschrieben. Als Punkte dargestellte Elektronen sind ungebundene Elektronen, die ein Elektronenpaar mit einem anderen Nichtmetallatom bilden können – man spricht von bindenden Elektronen.
3 Elektronen sind ungepaart (bindend). Stickstoff kann daher
3 Bindungen eingehen.
Betrachte die Darstellung von Stickstoff (Abb. 5)!
Du siehst, dass Stickstoff 3 bindende Elektronen aufweist,
Lerne nun am Beispiel Sauerstoff kennen, wie man vorgeht, um Elemente mit der Lewis-Schreibweise darzustellen!
Wie viele Außenelektronen hat ein Sauerstoff Atom?
Nun bist du dran! Zeichne Kohlenstoff (C), Phosphor (P), Fluor (F) und Neon (Ne) mit der Lewis-Schreibweise in deine Mappe!

(1875-1946)
Strukturformeln
Strukturformeln zeigen, wie Atome in einem Molekül verknüpft sind. Mit Hilfe der Lewis-Schreibweise können diese entwickelt werden.
Betrachte folgende Abbildung! Die Wasserstoffatome nähern sich einander an, die bindenden Elektronen bilden ein Elektronenpaar. Im Molekül Wasserstoff wird das Elektronenpaar beiden Atomen zugerechnet!
Bei anderen Molekülen geht man gleich vor. Beispielsweise siehst du bei Kohlenstoffdioxid (CO2), dass Elementen ab der 2. Periode in einem Molekül 8 Außenelektronen zugerechnet werden. Bei Kohlenstoffdioxid (CO2) geht Kohlenstoff 4 Bindungen ein. Dabei ist das Kohlenstoffatom mit 2 Sauerstoffatomen, jeweils über eine Doppelbindung, verbunden.
Übe das Darstellen von Molekülen mit Strukturformeln, indem du Stickstoff (N2), Brom (Br2) und Fluorwasserstoff (HF) in deine Mappe zeichnest! Vergleiche mit diesen Darstellungen und wähle die richtigen Schreibweisen aus!
1 / 12
Die Elektronenpaare ordnen sich mit dem größtmöglichen Abstand zueinander an. Dies führt zur räumlichen Anordnung der Moleküle. An der Strukturformel und am Kugel-Stab-Modell von Wasser erkennt man die gewinkelte Struktur.
Bei Ammoniak (NH3) wird die räumliche Struktur als pyramidal bezeichnet.
Molekül-Profi
Bist du schon ein Molekül-Profi? Teste dein Können!Isomerie
Je mehr Atome an einem Molekül beteiligt sind, umso mehr Kombinationsmöglichkeiten gibt es. Bei unterschiedlichen Verknüpfungen der gleichen Atome spricht man von Strukturisomerie. Zur eindeutigen Darstellung von Verknüpfungen innerhalb eines Moleküls helfen uns daher Strukturformeln.
Info für Lehrende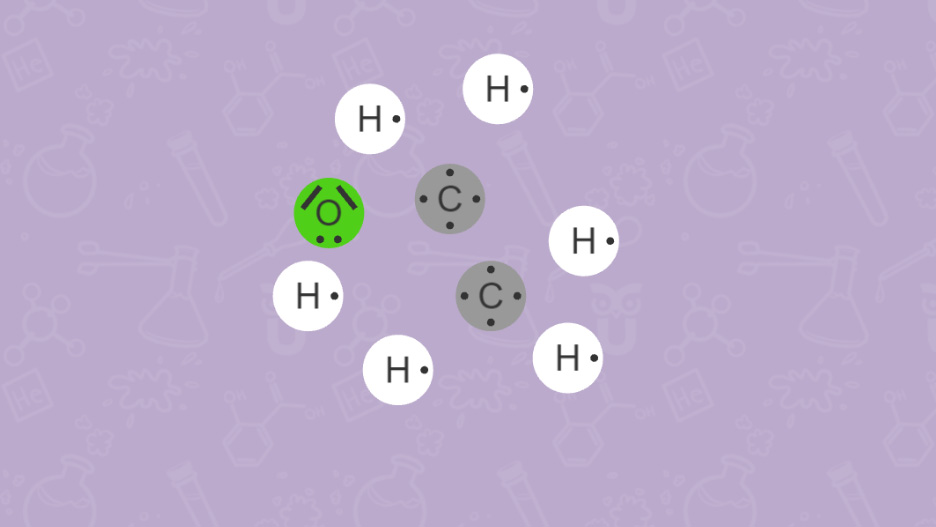
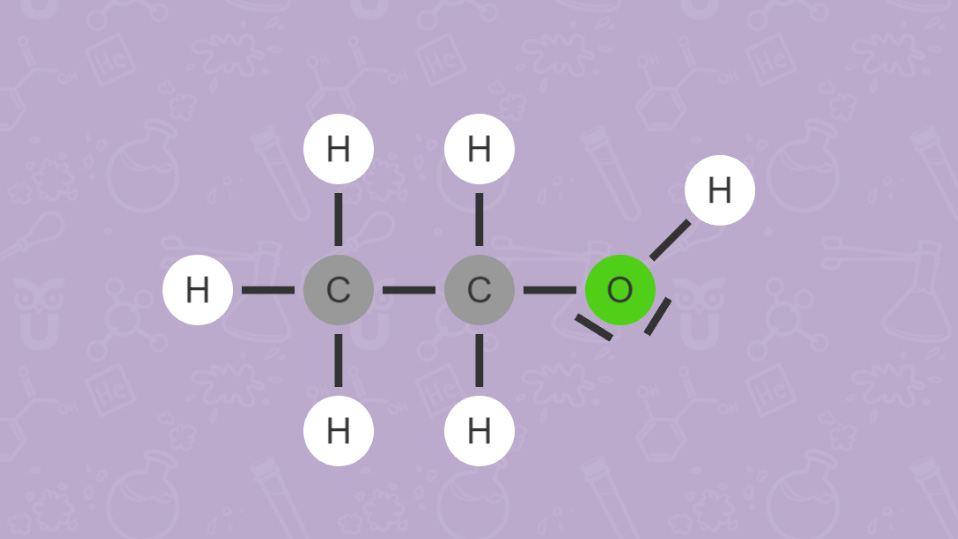
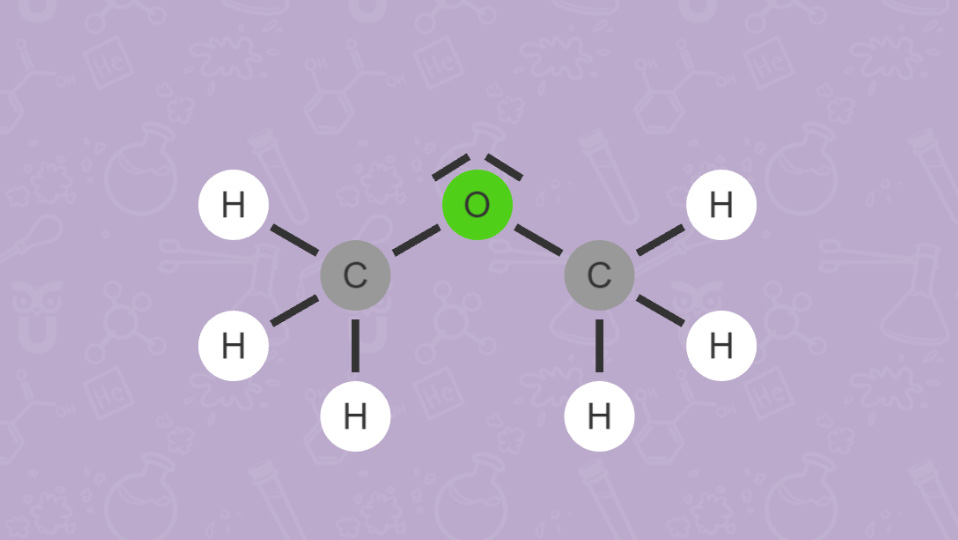
Wie du bei Ethanol (C2H5OH) und Dimethylether (CH3)2O sehen kannst, versucht man auch mit der Anordnung der Elementsymbole in einer Summenformel einen Hinweis auf die vorliegende Verbindung zu geben. Beispielsweise verweist die OH-Gruppe in Ethanol auf die Stoffklasse der Alkohole.

