Gitter aus Nichtmetallen
Neben den Ionen- und Metallgittern gibt es Gitterstrukturen, denen die Elektronenpaarbindung zugrunde liegt. Atomgitter bestehen aus Nichtmetall-Atomen, die durch die Elektronenpaarbindung miteinander verbunden sind. Molekülgitter entstehen durch die Wechselwirkungen zwischen Molekülen.
Info für Lehrende
Mehr zu SchuBu+
Atomgitter
Atomgitter liegen bei Diamant und Grafit, den bekanntesten Modifikationen des Kohlenstoffs, vor. Kohlenstoff hat vier Außenelektronen und kann daher vier Bindungen eingehen. Bei einem Diamanten ist jedes Kohlenstoff-Atom über Elektronenpaarbindungen mit jeweils vier anderen Kohlenstoff-Atomen verbunden – dadurch entstehen starre Gitterstrukturen. Stoffe, die aus Atomgittern aufgebaut sind, sind sehr hart und weisen hohe Schmelzpunkte auf.


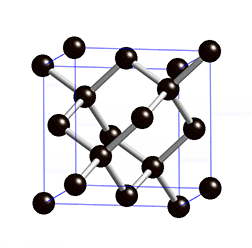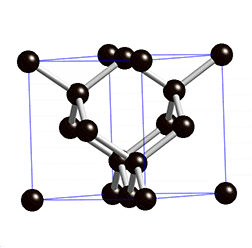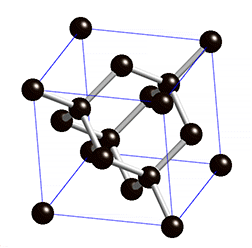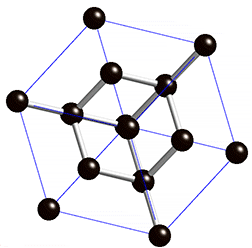
Ein Grenzfall ist Grafit, der nicht aus einem starren Gitter, sondern aus locker miteinander verbundenen Schichten, besteht. In diesen Schichten bildet ein Kohlenstoff-Atom nur drei Bindungen mit anderen Kohlenstoff-Atomen – ein Elektron bleibt also ungebunden. Diese Elektronen sind somit frei beweglich und sorgen für die elektrische Leitfähigkeit von Grafit. Die Grafitschichten sind gegeneinander verschiebbar, daher handelt es sich bei Grafit um ein sehr weiches Material. Im Alltag begegnet es uns als Mine in Bleistiften oder als Elektroden in Batterien.


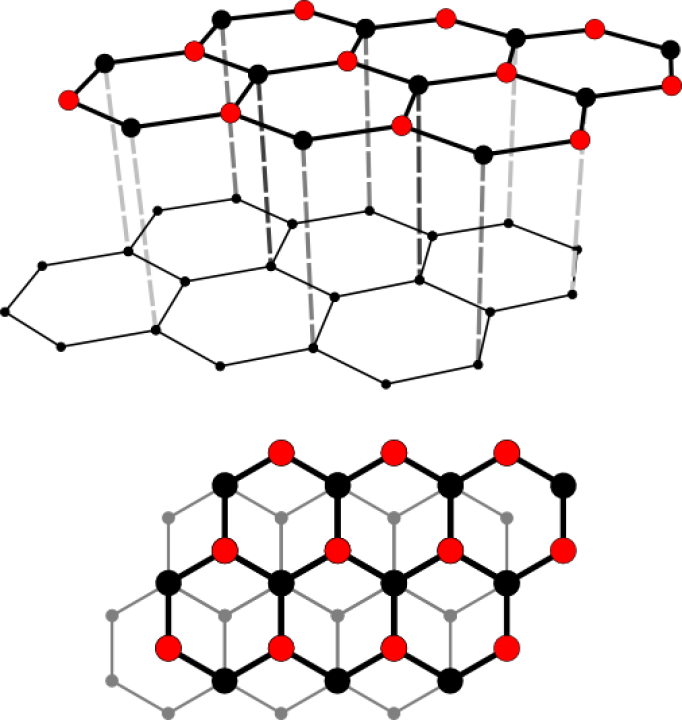
In welche Richtung findet in Grafit der Stromfluss statt?
Da sich die beweglichen Elektronen zwischen den Schichten befinden, bewegen sie sich innerhalb der Schichten, wodurch es zu einem Stromfluss kommt. Senkrecht auf die Grafitschichten kann Strom nicht geleitet werden.

Stromfluss-Messung
In welche Richtung findet in Grafit der Stromfluss statt? Verstelle die Regler für Rotation und Perspektive!Das Halbmetall Silicium bildet Gitterstrukturen, ähnlich wie ein Diamant. Da die Elektronenpaarbindung bei den Silicium-Kristallen aber schwächer ist, können bei höheren Temperaturen Bindungselektronen ihren Platz verlassen. So kommt eine schwache Leitfähigkeit zustande, Silicium ist daher ein Halbleiter.

Molekülgitter
Molekülgitter werden durch Wechselwirkungen zwischen Molekülen verursacht. Da diese Wechselwirkungen schwächer sind als die Bindungen in Salzen oder Atomgittern, sind Substanzen aus Molekülgittern weicher als beispielsweise Kochsalz und Diamanten. Ein Beispiel für Molekülgitter sind Kristalle aus Wasser (also Eis oder Schneeflocken). Durch die Wasserstoffbrücken sind die zu Eis erstarrten Moleküle in einem regelmäßigen Gitter (mit sechseckiger Struktur) angeordnet.


Wenn Wasser gefriert, bilden sich weiträumige Molekülgitter. Wasser dehnt sich also beim Erstarren aus. Dadurch hat Eis eine geringere Dichte als flüssiges Wasser. Das ist auch der Grund dafür, warum Eiswürfel in einem Wasserglas und Eisberge an der Wasseroberfläche schwimmen.


Dehnt sich ein Stoff wie beispielsweise Wasser bei Abkühlung aus, spricht man von Dichteanomalie. Wasser hat seine höchste Dichte bei 4 °C. Woran liegt das? Wenn Eis schmilzt, verlassen nicht alle Moleküle gleichzeitig ihre Position, es liegen immer noch regelmäßige Cluster vor. Bei 4 °C sind die regelmäßigen Anordnungen aufgebrochen und die Wassermoleküle rücken nahe zusammen. Wasser hat daher bei 4 °C das kleinste Volumen und damit die höchste Dichte. Wird das Wasser weiter erwärmt, rücken die Moleküle aufgrund der Zunahme der Bewegung wieder weiter auseinander, sodass die Dichte abnimmt.
In verschiedenen Bereichen des Alltags spielt die Zunahme des Volumens von Wasser beim Gefrieren eine wichtige Rolle, denn Wasser hat dadurch eine große Sprengkraft:
- Erstarrendes Wasser in kleinen Hohlräumen von Gestein kann dieses Zerstören und verändern (Verwitterung).
- Rohre, in denen Wasser gefriert, können platzen.
- Wasserreiche Lebensmittel dehnen im Gefrierschrank ihr Volumen aus – sehr gut verschlossene, voll gefüllte Behältnisse können sogar platzen.



Mit diesem einfachen Versuch lässt sich die Sprengkraft von Wasser sichtbar machen.

