Radioaktivität
Warum sind einige Atomkerne stabil, während andere instabil sind? Beim Verständnis von Halbwertszeiten und radioaktiven Umwandlungen können das Periodensystem der Elemente und Nuklidkarten hilfreich sind.
Info für Lehrende
Mehr zu SchuBu+
Materie, Atome und Periodensystem der Elemente
Materie ist alles, was man (theoretisch) anfassen kann. Materie kann je nach Temperatur und Druck fest, flüssig, gasförmig oder plasmaförmig vorliegen. Schon in der Vorstellung der antiken Philosophen bestand alle Materie aus winzigen Teilchen. Diese kleinsten Teilchen wurden damals als unteilbar angenommen und daher Atome genannt.
Bis heute hat sich die Bezeichnung „Atom“ für die kleinsten Teilchen der chemischen Elemente erhalten. Aber heute wissen wir:
- Jede Materie, egal ob fest, flüssig oder gasförmig, besteht aus Atomen (Teilchen).
- Zwischen den Atomen befindet sich nichts (keine Luft, kein Wasser, kein wie auch immer geartetes Medium).
- Jedes chemische Element hat seine eigenen Atome.
- Jedes Atom hat einen Kern aus positiv geladenen Protonen und ungeladenen Neutronen. (Kerne sind also immer positiv geladen.)
- Diese Kernteilchen (Nukleonen) sind wiederum aus je 3 wirklich unteilbaren Teilchen aufgebaut: den Quarks. Protonen bestehen aus zwei Up-Quarks und einem Down-Quark, Neutronen aus einem Up-Quark und zwei Down-Quarks.
- Jeder Kern wird von einer Hülle aus negativ geladenen Elektronen umgeben.
fm steht für Femtometer, das sind 10-15 m.
Elemente und ihre Kerne
Die chemischen Elemente und ihre Anordnung im Periodensystem der Elemente sind ein wichtiges Thema im Fach Chemie.
Was macht die einzelnen Elemente aus? Was unterscheidet Sauerstoff von Stickstoff, Silber von Gold, Lithium von Hafnium, ...?
Die Anzahl der Protonen im Kern bestimmt, um welches Element es sich handelt.
Die Anzahl der Protonen im Kern wird auch Kernladungszahl genannt (Protonen sind positiv geladen). Sie wird im Periodensystem als Ordnungszahl zur Reihung der Elemente verwendet.

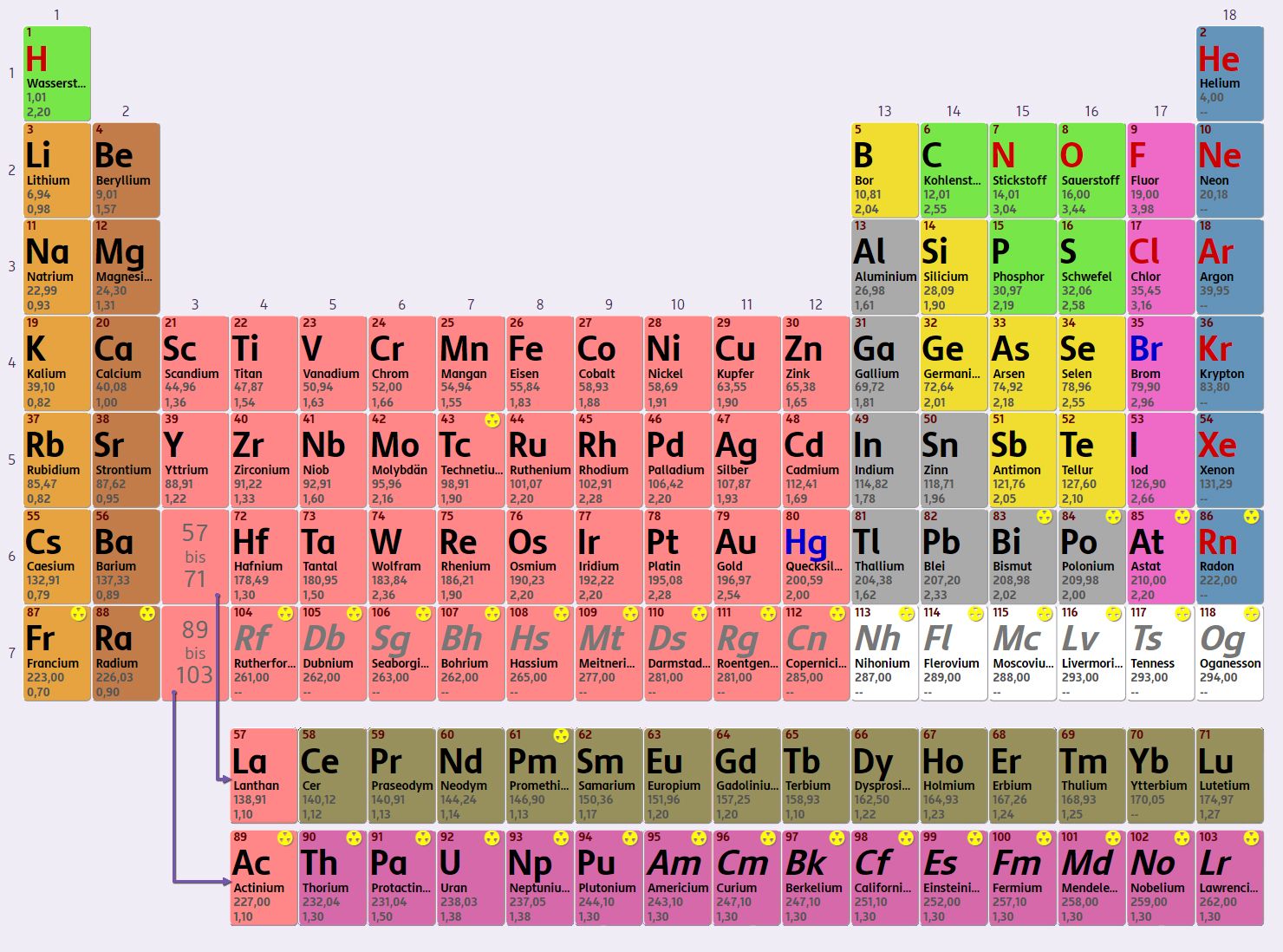
Periodensystem der Elemente
Möchtest du die Elemente genauer kennenlernen? Du findest sie im Periodensystem der Elemente!Weiters wird bei der Anordnung des Periodensystems der Bau der Elektronenhülle der Atome berücksichtigt. Die Elemente werden mit internationalen Elementsymbolen abgekürzt, wie zum Beispiel N für Stickstoff (Nitrogen), C für Kohlenstoff (Carbon), U für Uran, ...
Durch Addition der Anzahl der Protonen und Neutronen ergibt sich die Massenzahl eines Elements. Sie gibt in etwa die Atommasse an.
Jedes Element kommt in der Natur normalerweise als Gemisch von Varianten mit unterschiedlicher Neutronenzahl vor. Diese Varianten heißen Isotope.
Als Einheit der Atommasse wird wegen der unpraktisch kleinen Zahlenwerte statt Gramm die atomare Masseneinheit u ($$ 1\,u = 1{,}66056\cdot10^{-27}\,kg $$) verwendet. Sie entspricht einem Zwölftel der Atommasse des Kohlenstoffisotops $${}^{12}\textnormal{C}$$.
Die durchschnittliche Atommasse stellt einen gewichteten Durchschnittswert der Atommassen aller Isotope eines Elements dar. Bei der Ermittlung des Wertes wird auch berücksichtigt, in welchem Anteil die jeweiligen Atome auftreten. Elemente, bei denen ein Isotop stark überwiegt, haben daher einen nahezu ganzzahligen Wert (z. B. Kohlenstoff $$12{,}01\,u$$; Sauerstoff $$16{,}00\,u$$).
Perioden und Gruppen
Innerhalb einer Periode (=Zeile) nimmt die Anzahl der Protonen zu (z. B. Kohlenstoff C: $$ 6p^+ $$, Stickstoff N: $$ 7p^+ $$). Da im Periodensystem ungeladene Atome dargestellt sind, nimmt auch die Zahl der Elektronen zu.
Die Elemente in einer Spalte (Gruppe genannt) haben ähnliche chemische Eigenschaften. Daher tragen die Gruppen im Periodensystem eigene Namen, die einen Hinweis auf gemeinsame Eigenschaften geben können. Die 1. Gruppe bezeichnet man (mit Ausnahme von Wasserstoff) als Alkalimetalle, die 2. Gruppe umfasst die Erdalkalimetalle. Die Halogene (17. Gruppe) und Edelgase (18. Gruppe) sind wichtige Vertreter der Nichtmetalle.

Radioaktive Elemente im Periodensystem der Elemente
Radioaktive Atome haben instabile Kerne, die sich durch das spontane Aussenden von Teilchen in andere Kerne umwandeln.
Gibt es von einem Element keine stabile Form, so wird das Element im Periodensystem mit einem Symbol für Radioaktivität markiert (☢). Bei allen Elementen existieren zu den stabilen Atomsorten auch radioaktive Isotope, viele davon sind allerdings so kurzlebig, dass sie in der Natur selten vorkommen.
Isotope werden Kerne des gleichen Elements (gleiche Protonenzahl) genannt, die unterschiedliche Anzahl an Neutronen haben. Beispiele sind die natürlichen Nuklide $$\ce{ ^{12}_{6}C }$$, $$\ce{ ^{13}_{6}C }$$, und $$\ce{ ^{14}_{6}C }$$, die Isotope des Kohlenstoffes sind.
Für sie gilt:
- Alle von ihnen haben 6 Protonen (zu sehen an der Ordnungszahl 6)
- und gehören daher alle zum Element Kohlenstoff
- Sie unterscheiden sich nur in der Neutronenzahl: 6, 7 bzw. 8 Neutronen (= Massenzahl Minus Ordnungszahl)
- Alle drei Isotope des Kohlenstoffs haben 6 Elektronen (Elektronenanzahl= wie Protonenanzahl für elektrisch neutrale Atome)
Nuklid ist dabei die allgemeine Bezeichnung für ein Atom (oder einen Atomkern), das durch die Anzahl seiner Protonen und Neutronen charakterisiert wird. Zum Beispiel:
Radioaktive Isotope von Elementen werden daher auch oft Radionuklide genannt. $$\ce{ ^{14}_{6}C }$$ ist ein Radionuklid des Elements Kohlenstoff mit 6 Protonen und 8 Neutronen.
Stabile und instabile Kerne
Warum sind manche Kerne stabil und andere nicht? Warum sind Kerne überhaupt stabil, sie bestehen doch nur aus positiv geladenen und neutralen Teilchen und gleiche Ladungen stoßen sich ab? Oder?
Die Teilchen im Kern (= Nukleonen = Protonen & Neutronen) ziehen sich alle gegenseitig an. Die Kraft, die hier wirkt, wird Kernkraft genannt. Es ist die starke Wechselwirkung, die innerhalb der einzelnen Protonen und Neutronen wirkt und sie hat einige Besonderheiten:
- Die starke Wechselwirkung ist eine besonders starke Grundkraft, wesentlich stärker als die Gravitation oder die elektromagnetische Wechselwirkung.
- Aber sie hat eine sehr geringe Reichweite von nur etwa 2,5 Femtometer ($$ 2,5\,\textnormal{fm} = 2,5 \cdot 10^{-15}\,m $$).
Der Durchmesser der Nukleonen liegt bei etwa
Die elektromagnetische Wechselwirkung wirkt mit unendlicher Reichweite, aber nur zwischen den Protonen und aufgrund ihrer positiven Ladung abstoßend. (Neutronen sind keine Ladungsträger.) Dadurch wird die mögliche Größe der stabilen Atomkerne nach oben begrenzt. Denn auch in einem sehr großen Kern spürt ein Proton nur die Anziehung der unmittelbar benachbarten Neutronen und Protonen, aber die elektromagnetische Abstoßung aller im Kern vorhandenen Protonen.
Das führt dazu, dass alle Kerne mit über 82 Protonen (ab dem Element Blei) generell instabil sind. Instabile Atomkerne wandeln sich durch das spontane Aussenden von Teilchen in andere Kerne um.
Stabile Atomkerne wandeln sich nicht von selbst um. Sie sind stabil durch ihr günstiges Verhältnis von Protonen zu Neutronen.
Was genau „günstig“ bedeutet, ändert sich allerdings mit der Größe des Kernes:
- Sehr kleine Kerne sind besonders stabil, wenn sie gleich viele Neutronen wie Protonen haben.
- Je größer die Kerne werden, desto mehr Neutronen brauchen sie, um stabil zu sein. Der stabile Bereich ist dabei allerdings sehr schmal.
- Sowohl ein Neutronenüberschuss als auch ein Mangel an Neutronen macht die Kerne instabil.
Nuklidkarten
Um hier den Überblick nicht zu verlieren, werden in der Kernphysik Nuklidkarten verwendet. Sie sind für Kernphysikerinnen und Kernphysiker ähnlich wichtig wie das Periodensystem in der Chemie.
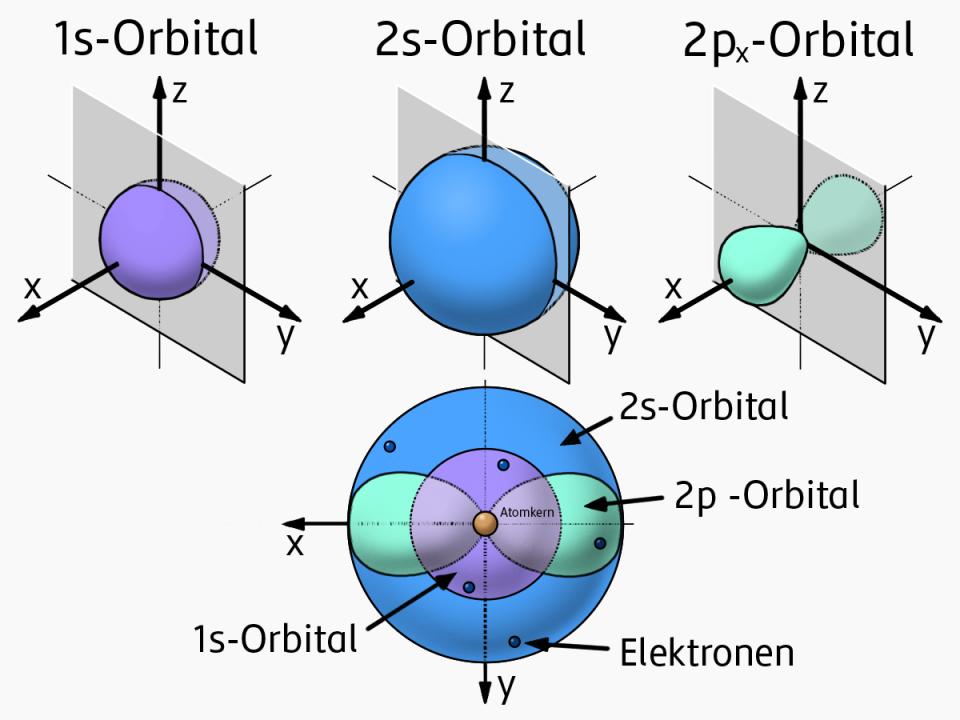
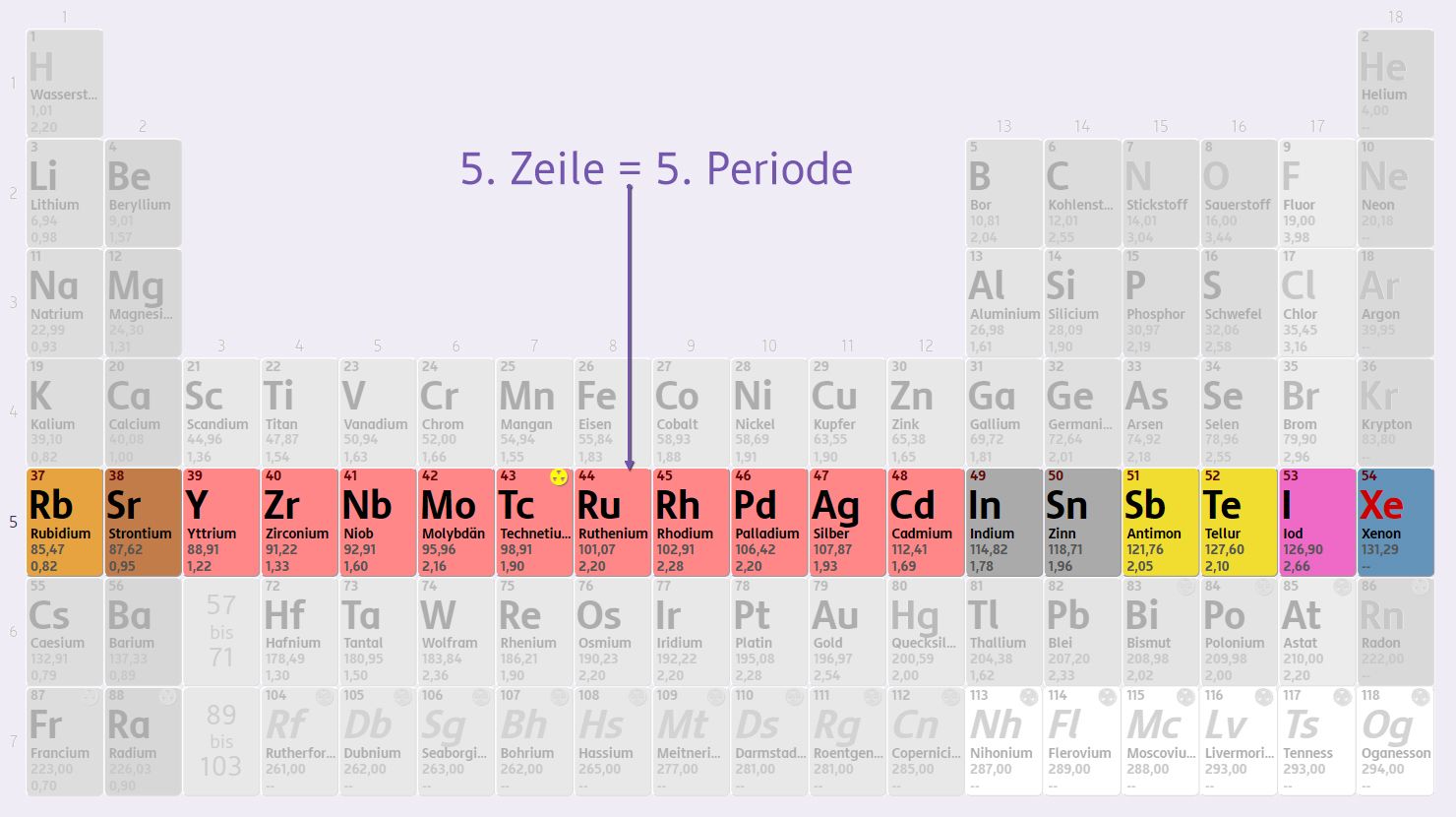
Während im Periodensystem die chemische Verwandtschaft und damit die Elektronenhülle mit ihren Orbitalen die Ordnungskriterien bilden, stehen bei der Nuklidkarte die Atomkerne im Vordergrund. Die Nuklidkarte zeigt die bekannten Nuklide sortiert nach der Anzahl der Protonen und Neutronen in den Kernen. In dieser Darstellung entspricht jede Zeile einem Element (Anzahl der Protonen = Ordnungszahl) und jedes Kästchen der Zeile einem Isotop des Elements:
Selber Nuklide bauen
Beobachte was passiert, wenn man einige Protonen, Elektronen und Neutronen in das Atom zieht: Info für Lehrende- Wodurch wird das Element bestimmt?
- Wodurch ändert sich die Massenzahl?
- Wodurch ändert sich die Ladungszahl?
Aktiviere unten rechts den Haken bei „Zeige Stabil / Instabil“ und baue folgendes Nuklid:
- Beobachte was passiert, wenn man einige Neutronen in das Nuklid zieht oder wegnimmt.
- Wieviele der Isotope, die du bilden kannst, sind stabil?
- Wie kannst du die stabilen Isotope in der Nuklidkarte erkennen?
Achtung Verwechslungsgefahr
Ordne den richtigen Begriff zu: Nuklid oder Nukleon?
- Die Teilchen im Kern nennt man .
- Radioaktive Atomkerne werden auch genannt.
- sind Protonen oder Neutronen.
- Ein durch Massenzahl und Anzahl der Protonen charakterisierter Atomkern wird genannt.
Ein Proton kann sowohl ein Nukleon als auch ein Nuklid sein. Warum?
Protonen (sowie Neutronen) sind Nukleonen. Nuklide sind Atomkerne mit einer fixen Zahl an Protonen und Neutronen. Das Nuklid 1H besteht nur aus einem Proton. Dieses Proton ist also gleichzeitig Nuklid und Nukleon.
Elektronen sind keine Nukleonen. Warum? Beantwortet die Frage gemeinsam mit der Klassenantwort! Geht dafür auf das Antworten-Tool!
Info für LehrendeRadioaktive Umwandlungen
Physikalische (oder chemische) Systeme wie z. B. Atome, Atomkerne, Seifenblasen, Bienenwaben, Wassertropfen, ... streben immer einen Zustand minimaler Energie an. Falls es für einen Atomkern einen Zustand gibt, der energetisch günstiger als sein jetziger ist, ist es daher sehr wahrscheinlich, dass er in diesen Zustand übergehen wird.
Genau das passiert mit instabilen Atomkernen bei der radioaktiven Umwandlung: Sie geben spontan Energie in Form von Strahlung ab und wandeln sich dabei in andere, energetisch günstigere Kerne um.
Um ein Gefühl dafür zu bekommen, eignen sich Hüpfspielzeuge wie diese Plopper. Es lässt sich für den einzelnen Plopper nicht vorher bestimmen, wann er genau hüpfen wird. Gerade das macht sie so lustig und überraschend. Gleichzeitig ist aber völlig klar, dass es innerhalb absehbarer Zeit passieren wird.

So ähnlich ist es auch mit den Radionukliden.
Halbwertszeit
Wann genau die Umwandlung eines einzelnen „Mutternuklides“ in das „Tochternuklid“ passieren wird, lässt sich für den einzelnen Kern nicht vorhersagen. Für eine größere Menge radioaktiver Nuklide lassen sich aber schon statistische Vorhersagen treffen und sogenannte Halbwertszeiten bestimmen:
Halbwertszeit ($$ t_{1/2} $$) nennt man die Zeitspanne, innerhalb der sich die Hälfte der Kerne spontan umgewandelt hat.
Sie ist eine wichtige Kenngröße für radioaktives Material und kann von Sekundenbruchteilen zu mehreren Quadrillionen (eine Zahl mit 24 Nullen, $$1 \cdot 10^{24} $$) von Jahren betragen.
Wie lange ein Material zur Umwandlung braucht, wirkt sich natürlich auch auf seine Aktivität, also die Anzahl der Umwandlungen pro Zeit aus. Die SI Einheit dafür ist das Becquerel. Es gibt die Anzahl der Atome an, die sich pro Sekunde umwandeln: $$ 1 Bq = 1/s $$.

Die Aktivität eines Materials ausgedrückt pro Masse (Becquerel pro Milligramm, Bq/mg = spezifische Aktivität) ist daher umso größer, je kürzer die Halbwertszeit ist.
| Isotop | Halbwertszeit | spezifische Aktivität |
|---|---|---|
| $$\ce{ ^{131}I }$$ | 8 Tage | 4 600 000 000 000 Bq/mg |
| $$\ce{ ^{3}H }$$ | 12,33 Jahre | 370 000 000 000 Bq/mg |
| $$\ce{ ^{137}Cs }$$ | 30 Jahre | 3 300 000 000 Bq/mg |
| $$\ce{ ^{239}Pu }$$ | 24 110 Jahre | 2 307 900 Bq/mg |
| $$\ce{ ^{235}U }$$ | 703 800 000 Jahre | 80 Bq/mg |
| $$\ce{ ^{232}Th }$$ | 14 050 000 000 Jahre | 4 Bq/mg |
Die Halbwertszeit ist für jedes radioaktive Material eine feste Größe, die sich kaum (oder nur sehr wenig) beeinflussen lässt.
Bestimme die Halbwertszeit der Plopper! Was könnte man machen, damit die Bestimmung möglichst genau wird?
Energie los werden, aber wie?
Wie genau ein Radionuklid Energie abgeben und sich umwandeln kann, hängt von der Art des Kernes ab.
Je nach Anzahl der Neutronen und Protonen im Kern ergeben sich unterschiedliche Szenarien. Folgende Umwandlungen sind am häufigsten:
| Farbe | radioaktive Umwandlung | Was passiert? | grafisch vereinfacht |
|---|---|---|---|
$$ \alpha $$ |
Alpha-Zerfall | ein Heliumkern wird abgestrahlt |
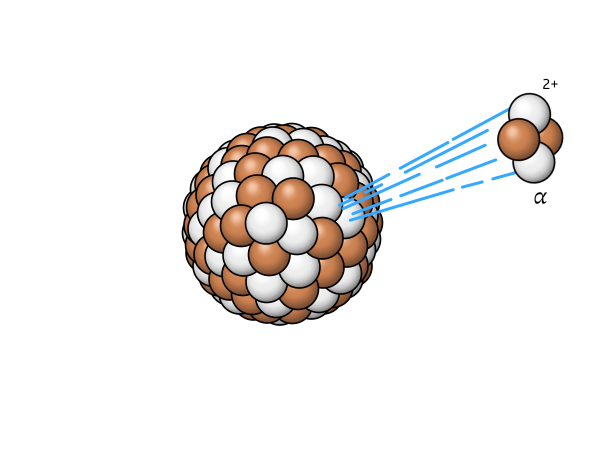
|
$$ \beta^- $$ |
Beta-minus-Zerfall | ein Neutron verwandelt sich in ein Proton und ein abgestrahltes Elektron |
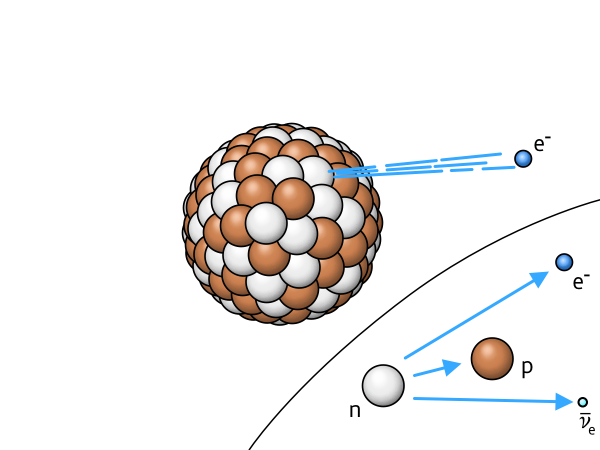
|
$$ \beta^+ $$ |
Beta-plus-Zerfall | ein Proton verwandelt sich in ein Neutron und ein abgestrahltes Positron |
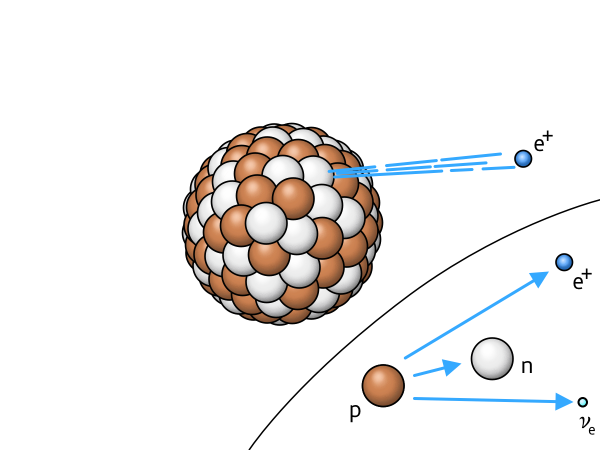
|
$$ \gamma $$ |
Gamma-Zerfall | Ein hochenergetisches Photon wird emittiert (elektromagnetische Strahlung), falls der Tochterkern nach dem Alpha- oder Beta-Zerfall in einem angeregten Zustand ist. |

|
| Seltene Zerfälle einblenden | |||
SF |
Spontane Spaltung | tritt manchmal als zusätzlicher Weg bei sehr schweren Kernen auf, Spaltung in zwei Kerne + Abgabe von 2-3 Neutronen |
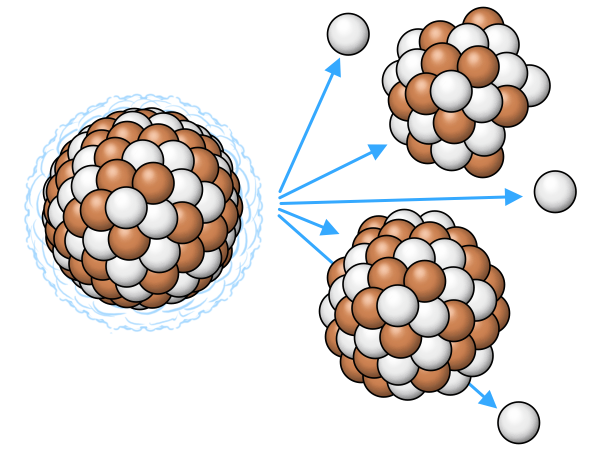
|
n |
Neutronenabgabe | bei Kernen mit extrem hohen Neutronenüberschuß wird ein Neutron abgegeben |
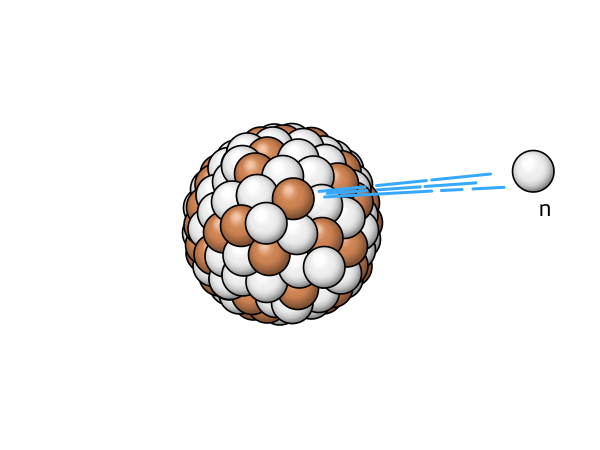
|
p |
Protonenabgabe | bei Kernen mit extrem hohen Protonenüberschuß wird ein Proton abgegeben |
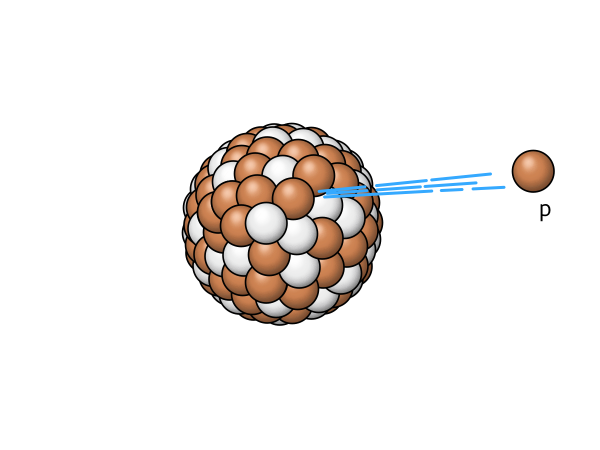
|
Mit Hilfe der Nuklidkarte lässt sich gut darstellen (und ablesen) bei welchen Kernen welche Umwandlungen auftreten und welche Tochterkerne daraus entstehen:
Finde ! Welchem Zerfall folgt dieses Isotop?
Alpha-, Beta- und Gamma-Strahlung verhalten sich unterschiedlich, wenn sie auf Materie treffen. Allerdings sind alle 3 ionisierende Strahlen und hinterlassen daher auch im menschlichen Körper Ionisierungsspuren. Das kann zu irreparablen Schäden am Erbgut von Zellen führen. Solche Schäden haben zur Folge, dass sich Zellen nicht mehr teilen können, sterben oder zu Krebszellen werden, falls sie vom Körper nicht repariert werden können.
Abschirmung und Reichweite
Während Alpha-Strahlung (Heliumkerne) in Luft immerhin einige Zentimeter weit kommt, ist ihre Reichweite in Wasser oder im Körper deutlich kürzer. Hier kann Alphastrahlung nur ein paar Mikrometer weit reichen. Das ist aber ausreichend, um zum Beispiel innerhalb des Körpers durch Einatmen oder Aufnahme mit der Nahrung schwere Schäden anzurichten. Von außen dringt sie hingegen nicht durch unsere Hornhaut und wird schon von einem Blatt Papier abgeschirmt.
Die Reichweite der Alpha-Strahlung ist so gering, weil die vergleichsweise großen Heliumkerne, durch häufige Zusammenstöße mit anderen Molekülen, sehr schnell ihre Bewegungsenergie verlieren.
Beta-Strahlung (Positronen oder Elektronen) kommt in Luft einige Meter weit, hier reicht ein Blatt Papier nicht mehr, aber ein dickes Buch oder 5 mm dickes Aluminiumblech schirmt sie ab.
Gamma-Strahlung (hochenergetische elektromagnetische Strahlung, Photonen) kann in Luft kilometerweit reichen und breitet sich mit Lichtgeschwindigkeit aus. Mehrere Meter Beton oder dicke Bleiwände können zur Abschirmung benutzt werden.
Da Gamma-Strahlung nicht aus Materie besteht, kann sie sich auch schneller und ungehinderter ausbreiten.
Abschirmung von Strahlung im Vergleich
Teste unterschiedliche Materialien mit den verschiedenen Strahlungsquellen!

